
Реактивы
Где лаборатория, там, конечно, и реактивы. Для фотолюбителя существуют две возможности приобрести нужный набор химических веществ. Можно, например, покупать реактивы по отдельности: многие из них достаточно "ходовые", продаются в мелкой расфасовке в фотомагазинах, аптеках и даже в магазинах хозяйственных товаров. Подобрав некоторый минимум необходимых вам химикатов, вы сможете из большого числа проверенных рецептов выбрать наиболее вас устраивающие, что немаловажно. По заявкам организаций, школ, фотоклубов почти все реактивы можно приобрести в специализированных магазинах Химреактивсбыта.
Но зачастую проще, да и удобнее составлять растворы из готовых смесей, которые фасуются на заводах; ассортимент их достаточно разнообразен. Это самые различные проявители для пленок и бумаги, фиксажи, усилители и ослабители, виражи, полные наборы для обработки цветных фотопленок и бумаг. Главное преимущество подобных наборов - проверенная рецептура, высокое и стабильное качество, а также, что очень удобно, возможность быстро приготовить рабочие растворы, не прибегая к взвешиванию и другим трудоемким операциям. На чем вы остановитесь, зависит только от вас, но с успехом, конечно, можно пользоваться и обоими методами сразу. Для меня, например, одно удовольствие повозиться с веществами, отвешивая и отмеривая их...
Весы,- может быть, и не такие точные, обязательная принадлежность в лаборатории школьного фотокружка
Из школьного курса химии вспомните, что ряд реактивов может существовать в безводной или кристаллогидратной форме (фотографы не очень точно называют эту форму "кристаллической"). В молекуле "кристаллического" реактива (кристаллогидрата) содержится определенное число молекул кристаллизационной воды, поэтому "кристаллического" вещества (кристаллогидрата) всегда приходится брать больше, чем безводного. В рецепте, как правило, указывается, о какой форме вещества идет речь, а по молекулярным массам обоих соединений нетрудно сделать соответствующий пересчет.?
Пример. По рецепту требуется 52 г безводного карбоната натрия, а у фотографа имеется только кристаллогидрат. Сколько соли нужно взять? Карбонат натрия безводный-это Na2CO3, его молекулярная масса 106.
Кристаллогидрат Na2CO3 · 10 Н2О, молекулярная масса 286. Для пересчета составляется простая пропорция, которую решают относительно неизвестного:
106 г безводной соли соответствуют 286 г кристаллогидрата, 52 г безводной соли должны соответствовать х г кристаллогидрита. Отсюда
| х= | 52·286 | =140,3 г. |
| 106 |
Не забывайте, что не всегда явно кристаллическая форма химиката свидетельствует о наличии в нем кристаллизационной воды. Бромид калия, например, да и многие другие кристаллические соли ее не содержат*.
* (Поскольку в фотографии за кристаллогидратом издавна закреплен и считается общепринятым термин "кристаллический" (крист.), мы в дальнейшем будем им пользоваться, опустив кавычки.)
Полезный совет. Для пересчетов приходится пользоваться атомными массами элементов, поэтому всегда иметь под рукой Периодическую таблицу элементов Д. И. Менделеева нужно не только химику, но и фотографу.
Фотографы часто пытаются заменить одно химическое соединение другим, аналогичным по его роли в обрабатывающем растворе. На вопрос, чем и что можно заменять, единого ответа нет (это зависит в первую очередь от типа и назначения раствора), а наиболее общий ответ на такой вопрос, увы, отрицателен. Единственная полноценная и, безусловно, допустимая замена-это замена безводных форм на кристаллогидратные, и наоборот. Во всех остальных случаях замена даже на химически близкое по характеру соединение (например, карбоната натрия на карбонат калия) может сильно повлиять на специфические особенности выбранного рецепта. Нужно четко представлять себе, насколько важна роль каждого реактива в данном растворе, и самостоятельно оценить минусы, возникающие при его замене.
Попробуем для некоторых часто встречающихся случаев показать общий подход к этому практически важному вопросу.
Можно ли в мелкозернистом проявителе для пленки заменить одно соединение, дающее щелочную реакцию, другим? Казалось бы, можно, если обеспечить при такой замене одну и ту же кислотность (значение pH), от которой при прочих равных условиях зависит энергия действия проявителя*. На деле все сложнее: при замене может нарушиться буферность раствора, или, проще, стабильность его свойств при проявлении последующих пленок, а также и некоторые другие полезные характеристики, например способность обеспечивать высокую мелкозернистость изображения. Вспомним, что проявление пленок проводится по времени, без визуального контроля, и получается, что такая замена скажется, и, скорее всего существенно, на качестве окончательного изображения.
* (Все проявители имеют щелочную реакцию (pH > 7), но все равно правильнее говорить не о "щелочности", а о кислотности. Это определение относится и к кислым, и к щелочным растворам.)
Полезный совет.В проявителях для пленок какие-либо замены реактивов нежелательны!
Еще более жестко обстоит дело с рецептами для обработки цветных фотоматериалов. Качественное изображение на них получается только при строго регламентированном воздействии на каждый из трех светочувствительных эмульсионных слоев, в каждом из которых изображение образует один из красителей - желтый, пурпурный и голубой. Воздействие же это определяется не только химическим составом раствора, но и физическими процессами: ведь любая обработка светочувствительного слоя-это диффузионное проникновение раствора в его толщу. Скорость такого проникновения обусловлена и кислотностью, и температурой, и интенсивностью перемешивания, и даже молекулярной массой каждого соединения, так как от нее зависит подвижность молекул. Попробуй учти здесь все эти обстоятельства, если начал произвольно "химичить" с рекомендованной заводом и тщательно отработанной рецептурой!
Что касается черно-белых отпечатков, то они проявляются прямо "на глазах", при свете лабораторного фонаря. Кроме того, их рекомендуется держать в проявителе, пока не завершится полностью потемнение правильно экспонированного снимка. Только это дает хороший контраст, насыщенность, проработку всех деталей, столь желательную на окончательном снимке сочность.
Не запутаться бы в баночках...
Даже в сильно различающихся по составу позитивных проявителях проконтролировать ход процесса достаточно легко. Так что в этом случае вполне допустимы замены, которые оказались бы совершенно "криминальными" в проявителях для пленок, например замена одной щелочи на другую, добавление проявляющих веществ, использование реактивов на пределе (или даже за пределами) сроков их хранения. Еще более "либерален" подход к составлению, например, кислых фиксажей, для которых важно лишь само наличие кислотности и достаточное содержание тиосульфата натрия. Поэтому при составлении такого фиксажа допустимо использовать любую слабую кислоту, а чтобы тиосульфат не разложился, кислоту добавляют сначала к раствору сульфита натрия и полученную "смесь" приливают к раствору тиосульфата.
Чистота реактивов часто играет в фотографии решающую роль. Напомним, что химикаты могут быть техническими (т. е. содержать наибольшее количество посторонних примесей) и высокой степени очистки ("ч" - чистый, "чда" - чистый для анализа, "хч" - химически чистый). В магазинах фототоваров вы можете увидеть реактивы марки "Фото", а также реактивы разной сортности. Пользоваться очень чистыми реактивами - излишняя роскошь, но и технические продукты в большинстве случаев непригодны: непредусмотренные рецептом примеси способны испортить даже самый "непритязательный" фотографический раствор. Реактивы, приобретаемые в магазинах фототоваров или аптеках, годятся без всяких ограничений, за исключением, пожалуй, одного, но важного случая. Речь идет о сульфите натрия марки "Фото". По техническим условиям он может содержать до 6% карбоната натрия. Для позитивных проявителей это несущественно - они будут действовать лишь более энергично. А вот для специальных мелкозернистых проявителей, предназначенных для обработки малоформатных фотопленок, это обстоятельство станет катастрофическим. Энергичная "работа" здесь совсем не требуется, а добавка нескольких граммов карбоната натрия полностью нарушит специфику действия рецепта и приведет к сильнейшему перепроявлению и потере мелкозернистости и выравнивающих свойств. Судите сами: один из типичных рецептов мелкозернистых проявителей содержит 100 г сульфита натрия и 4 г тетрабората натрия, создающего слабую щелочность. Что станет с проявителем, если с этим сульфитом в него попадет около 6 г гораздо более активного щелочного агента-карбоната натрия? Не с этим ли связано столь частое перепроявление пленок при самостоятельном приготовлении растворов? Поэтому для пленочных проявителей применяют сульфит натрия квалификации не ниже чем "чистый" (он может содержать всего 0,1% карбоната натрия).
Можно и самим нейтрализовать сульфит "Фото", после чего его раствор будет пригоден для приготовления мелкозернистых проявителей. Для этого берут раствор какой-либо соли, дающей кислую реакцию (дисульфит калия или гидросульфит натрия), или разбавленную уксусную кислоту (столовый уксус). Отвешивают весь сульфит, необходимый для приготовления нужного объема проявителя, и увеличивают эту навеску на величину, приходящуюся в среднем на примеси (можно считать, что добавка составляет 5%). Так, если по рецепту на 1 л проявителя нужно 100 г сульфита натрия, берут 105 г реактива марки "Фото". Эту соль растворяют в половинном объеме воды; т. е., если вы хотите приготовить 1 л проявителя, растворите сульфит натрия примерно в 0,5 л воды. Добавьте в раствор несколько капель раствора любого индикатора (лакмуса или фенолфталеина; последний продается в аптеках). Раствор сульфита натрия должен окраситься в ясно различимый цвет, который присущ данному индикатору в щелочной среде. Затем небольшими порциями при постоянном перемешивании влейте в раствор заранее приготовленный раствор кислой соли или уксусной кислоты, пока окраска индикатора не исчезнет или не станет едва различимой.
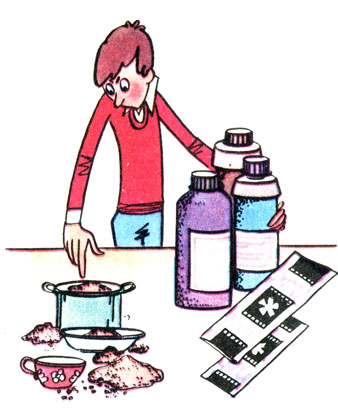
Самый надежный способ испортить пленки и отпечатки, а самому попасть в больницу. Никогда не используйте кухонную посуду для приготовления растворов!
Не нужно "перекислять" раствор (т. е. добавлять кислую соль или уксусную кислоту в избытке, до четко кислой среды, что сразу можно будет определить по изменению окраски раствора); незначительная щелочность присуща и растворам химически чистого сульфита натрия, и это учитывается при разработке рецептов проявителей. Чтобы закончить приготовление проявителя, все остальные реактивы в предусмотренной рецептом последовательности растворите в подготовленном растворе сульфита. Исключением является только метол, который в концентрированных растворах сульфита натрия растворяется очень плохо. Его растворяют отдельно в небольшом (но достаточном для полного растворения) объеме воды и добавляют к раствору все остальные вещества, после чего проявитель доводят до нужного объема (например, 1 л).
Большинство реактивов со временем изменяет свои свойства и портится. Практически важный вопрос: как определить их пригодность?
Ведь во многих случаях их вполне можно применять даже после истечения гарантийного срока, который часто указывается на упаковке.
Один из главных признаков порчи - изменение внешнего вида по сравнению с заведомо хорошим продуктом. Это может быть потемнение (особенно для проявляющих веществ), изменение структуры (превращение кристаллов в порошок, слипание в комки, "расплывание" при насыщении атмосферной влагой), появление разных налетов, корок и т. п. Характер изменений связан с химическими реакциями, которым подвержен реактив при хранении. Проявляющие вещества в основном окисляются, и когда они становятся темно-бурыми, теряют свои проявляющие свойства. Но это хотя бы видно. Другие реактивы ведут себя более "коварно". Сульфит натрия, например, превращается в другое вещество, не изменяясь внешне: кристаллический становится похожим на безводную соль, и только. Некоторые реактивы - гидроксид натрия, тиоцианат калия, хлорид железа (III) - очень гигроскопичны: даже свежие, они расплываются в полужидкую массу, которую невозможно точно отмерить или отвесить.
У фотолюбителя нет возможности выполнить химический анализ и проверить, годен ли еще химикат для фотографических работ. Поэтому, если вы сомневаетесь в качестве реактива, лучше сразу же замените его свежим, заведомо пригодным; можно для пробы обработать "сомнительным" раствором небольшой кусочек отснятого материала (это, кстати, самый простой способ проверить пригодность долго хранившихся растворов, которые выглядят еще хорошими).
Полезный совет.Не забывайте основного правила химиков - безжалостно выбрасывать все склянки и пакеты без этикеток, даже если вам кажется, что вы совершенно точно знаете, что в них находится.
Это правило часто считают чрезмерным и пренебрегают им, но, поверьте, что напрасно. Неправильно составленный раствор и испорченный снимок-это еще только минимальные неприятности, которые могут произойти при небрежном обращении с реактивами. Гораздо хуже, если придется обращаться к врачу. Кстати, к врачу всегда нужно обращаться немедленно, не занимаясь самолечением, если случайно какой-нибудь реактив попадет внутрь организма или в открытые ранки, если произойдет явное отравление, ожог кожи или, что еще хуже, глаз. Занятия фотографией не связаны, конечно, с какими-то особо вредными воздействиями на организм, и тем не менее не следует пренебрегать выработанными за многие годы мерами предосторожности, обязательными для любого химического кружка.
Полезный совет.Будьте предельно осторожны, работая с едкими веществами - щелочами, кислотами. Помните: при разбавлении концентрированных кислот никогда нельзя лить воду в кислоту, только наоборот: кислоту лить в воду! Это предотвратит возможное разбрызгивание, ожоги и порчу одежды.
Вспомните и многие другие правила работы в школьном химическом кружке, они вам пригодятся при занятиях фотографией. Здесь обязательны та же скрупулезная аккуратность и мелочная пунктуальность, в этом - гарантия полной безопасности и успеха в работе.
Говоря о реактивах, приходится особо остановиться на их названиях. Используемая в книге современная номенклатура химических веществ знакома школьникам, однако у читателя, мало знакомого с химией, она может вызвать затруднения. Дело в том, что поступающие в торговую сеть реактивы часто имеют тривиальные названия, отличающиеся от номенклатурных. Поэтому для удобства в конце книги дан гель названий реактивов", в котором приведены как современные номенклатурные, так и бессистемные тривиальные, традиционные и некоторые фирменные названия применяемых в фотографии реактивов. Таким образом, если читатель встретит в книге неизвестное ему название, то он легко найдет по "Указателю" другое, более знакомое название интересующего его реактива.
|
ПОИСК:
|

© Istoriya-Foto.ru 2010-2019
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://istoriya-foto.ru/ 'Фотоискусство'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://istoriya-foto.ru/ 'Фотоискусство'